Phẫu thuật cho bướu Wilms
Bướu Wilms, điều trị bao gồm phẫu thuật (cắt thận toàn phần hay bán phần) là ung thư đứng hàng thứ 5 ở trẻ em và là ung thư thận hàng đầu ở trẻ em. Điều trị bướu Wilms là một điển hình thành công do áp dụng kết hợp đa mô thức dựa theo National Wilms' Tumor Study Group (NWTSG) và Societe Internationale d'Oncologie Pediatrique (SIOP).
Trong 50 năm qua, chỉ với phẫu thuật thì tỷ lệ sống còn sau 2 năm sau cắt thận chỉ là 20%. Sau này kết hợp xạ trị hỗ trợ thì tỷ lệ sống còn tăng lên 50%. Nhờ vào sự kết hợp của các nhà ung thư học, phẫu thuật, giải phẫu bệnh và với những thuốc mới vincristine, dactinomycin (actinomycin D), và doxorubicin, thì tỷ lệ sống còn trong thế kỷ 20 lên 90%.
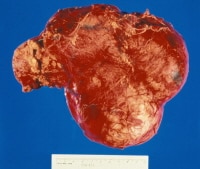 |
| Bướu đẩy mô thận bình thường sang 1 bên |
Giải phẫu
Bướu Wilms có nguồn gốc từ mô thận nguyên thủy của phôi. Đại thể là một bướu đặc hoặc nang, có thể đẩy lệch hệ thống bài tiết trong thận. Bướu xâm lấn tĩnh mạch thận chiếm 40%. Trong những trường hợp hiếm bướu lan xuống tới niệu quản và bàng quang có thể gây tiểu máu. Bướu 2 bên chiếm 6%. Bướu xâm lấn tại chỗ cũng hiếm bướu thường di căn theo đường máu và bạch huyết.
Chống chỉ định
Khi bướu có cả hai bên và bướu đã di căn. Bướu lớn quá vượt khỏi đường giữa, xâm lấn mạch máu nưng cả hai điều trên chỉ là chống chỉ định tương đối. Vì vài phẫu thuật viên có tể cắt hết bướu đặc nhưng tăng nguy cơ phẫu thuật cho bệnh nhân.
Theo phát đồ của NWTSG, bướu đầu tiên trong điều trị là phẫu thuật cắt thận tận gốc nếu có thể được. Thám sát vùng bụng qua đường rạch bụng ngang. Thận được thám sát bắng cách bóc tách đại tràng cùng bên à mở cân Gerota. Thám sát thận đối bên không được khuyến cáo vì đã có những phương tiện chuẩn đoán hình ảnh học tốt. Nếu có bị bệnh cả 2 bên thì không cắt thận nhưng cũng có thể sinh thiết. Phát đồ điều trị bướu 2 bên đang được nghiên cứu và phát triển. Nếu bệnh chỉ có 1 bên thì cắt thận và nạo hạch vùng là cần thiết.
Cắt thận bán phần
Bướu Wilms có nguồn gốc từ mô thận nguyên thủy của phôi. Đại thể là một bướu đặc hoặc nang, có thể đẩy lệch hệ thống bài tiết trong thận. Bướu xâm lấn tĩnh mạch thận chiếm 40%. Trong những trường hợp hiếm bướu lan xuống tới niệu quản và bàng quang có thể gây tiểu máu. Bướu 2 bên chiếm 6%. Bướu xâm lấn tại chỗ cũng hiếm bướu thường di căn theo đường máu và bạch huyết.
Chống chỉ định
Khi bướu có cả hai bên và bướu đã di căn. Bướu lớn quá vượt khỏi đường giữa, xâm lấn mạch máu nưng cả hai điều trên chỉ là chống chỉ định tương đối. Vì vài phẫu thuật viên có tể cắt hết bướu đặc nhưng tăng nguy cơ phẫu thuật cho bệnh nhân.
Cắt thận toàn phần
Theo phát đồ của NWTSG, bướu đầu tiên trong điều trị là phẫu thuật cắt thận tận gốc nếu có thể được. Thám sát vùng bụng qua đường rạch bụng ngang. Thận được thám sát bắng cách bóc tách đại tràng cùng bên à mở cân Gerota. Thám sát thận đối bên không được khuyến cáo vì đã có những phương tiện chuẩn đoán hình ảnh học tốt. Nếu có bị bệnh cả 2 bên thì không cắt thận nhưng cũng có thể sinh thiết. Phát đồ điều trị bướu 2 bên đang được nghiên cứu và phát triển. Nếu bệnh chỉ có 1 bên thì cắt thận và nạo hạch vùng là cần thiết.
Cắt thận bán phần
Vai trò cắt thận bán phần vẫn còn đang bàn cãi . Mặc dù suy thận giai đoạn cuối sau cắt tận một bên là hiếm (0,25% trong thủ nghiệm của NWTSG), bảo tồn mô thận lành có thể ngừa biến chứng này, đặc biệt ở những bệnh nhân có bệnh nội khoa ( hội chứng WAGR, và Denys-Drash). Cắt thận bán phần khả thi chỉ trong 10-15% bệnh nhân, vì phần lớn bướu là quá lớn khi phát hiện. Và lo lắng nữa là cắt thận bán phần làm cho bướu tái phát tại chỗ. Theo nghiên cứu NWTS-4 thấy 8% tái phát tại chỗ sau cắt bán phần thận vì bướu 2 bên.[3] Trong trường hợp bướu 2 bên, thận độc nhất, suy thận, thì nên xem xét cắt thận bán phần.
Chuẩn bị trước phẫu thuật
Nếu bướu không cắt được thì nên sinh thiết sau đó hóa trị cắt thận trì hoãn, trong hầu hết các trường hợp làm bướu nhỏ lại. Sự dính vào cơ quan lân cận thường bị đánh giá quá mức. Biến chứng toàn bộ của phẫu thuật là 20%. Nếu bướu có chồi trong tĩnh mạch thì hóa trị trước phẫu thuật giảm được nguy cơ mở tĩnh mạch lấy chồi 50%
Bướu Wilms 2 bên (6%), mỗ thám sát, sinh thiết 2 bên, đánh giá chính xác giai đoạn (bao gồm sinh thiết hạch hai bên) là nên thực hiện, 6 tuần hóa trị sau đó. Sau đó đánh giá lại bằng chẩn đoán hình ảnh trước khi quyết định điều trị triệt để (1) cắt thận 1 bên và bán phần bên kia (2) cắt thận bán phần 2 bên (3) ch3 cắt thận toàn phần 1 bên, nếu đáp ứng là toàn diện bên đối diện, hướng này làm giảm nguy cơ suy thận. Sống còn 2 năm là cao theo hướng này hơn 80%, tỷ lệ cắt thận giảm 50% ở bệnh nhân có bướu cả hai bên. Cắt thận bán phần 2 bên sau hóa trị hoặc 1 bên đáp ứng tốt hóa trị thì không cần cắt thận.
Hóa trị
Điều trị đa mô thức (phẫu, xạ, hóa) là chìa khóa thành công trong điều trị. [4] Theo khuyến cáo NWTSG hóa trị trước phẫu thuật (sau mở bụng thám sát và sinh thiết) trong những tình huống sau[5, 6, 7] :
- Bướu xâm lấn vào tĩnh mạch - 5% và 40% biến cứng phẫu thuật. Ngay cả ở trong tay người ptv giỏi. Vì vậy hóa trị trước phẫu thuật làm nhỏ đi kích thước của chồi tĩnh mạch chiếm 25% biến chứng phẫu thuật.
- Ở những bướu lớn không thể phẫu thuật được thì hóa trị làm giảm kích thước bướu 50%
- Bướu Wilms 2 bên
Hóa trị kèm mà không đánh giá giai đoạn phẫu thuật thích hợp (chỉ đánh giá bằng hình ảnh học) có thể thay đổi giai đoạn thật sự ban đầu của bướu lúc phẫu thuật và cuối cùng thay đổi quyết định liên quan tới hóa trị hỗ trợ hay xạ trị, mà điều này dựa trên đánh giá giai đoạn bằng phẫu thuật.
Trong lúc mổ
Rạch da đường mỗ ngang bụng, vào cân Gerota (cân quanh thận) để thám sát thận. Trong trường hợp bướu thận 1 bên tiến hành cắt thận toàn phần nếu bên kia là còn bình thường. Đánh giá gan, hạch, tìm di căn trong phúc mạc. Tĩnh mạch thận và tĩnh mạch chủ dưới nên sớ nắn xem có chồi (6%). Trong trường hợp bướu 2 bên sinh thiết bướu nghi ngờ, sau đó có thể cắt lại sau khi hóa trị để bảo tồn nhu mô thận. Xác định 2 bên có hạch không, đánh dấu bằng clip sắt để sau này có thể xạ trị.
Lấy mẫu phải gọn ràng không rơi vãi mô ung thư ( tăng 6 lần di căn trong ổ bụng).
Hóa trị sau phẫu thuật và xạ trị dựa trên giai đoạn đánh giá bằng phẫu thuật theo hướng dẫn của NWTSG.
Bướu giai đoạn 1, giai đoạn mô học thuận lợi và không thuận lợi hay giai đoạn 2 thì nên :
- Cắt thận
- Sau đó vincristine and actinomycin D (18 tuần)
Giai đoạn II (stage II) anaplasia hoặc giai đoạn III mô hoạc thuận lợi (favorable histology) và focal anaplasia thì:
- Cắt thận
- Xạ trị vùng bụng (1000 cGy)
- Vincristine, actinomycin D, và doxorubicin (24 tuần)
Giai đoạn IV với mô học thuận lợi hoặc focal anaplasia:
- Cắt thận
- Xạ trị vùng bụng phụ thuộc vào giai đoạn tại chỗ
- Tia xạ phổi 2 bên (1200 cGy) kèm sulfamethoxazole và trimethoprim (Bactrim) phòng ngừa nhiễm Pneumocystis carinii
- Hóa trị vincristine, actinomycin D, và doxorubicin
Gai đoạn II và IV anaplasia lan tỏa:
- Cắt thận
- Xạ trị vùng bụng
- Xạ trị toàn phổi giai đoạn IV
- Hóa trị 24 tháng vincristine, actinomycin D, doxorubicin, etoposide, và cyclophosphamide
Bướu 2 bên, có mô học không thuận lợi thường có tiên lượng rất xấu dù điều trị đa mô thức.
Theo dõi
Theo dõi sau điều trị kéo dài (nếu có thể suốt đời), bởi vì bệnh có thể tái phát sau vài năm. Theo dõi bao gồm x-quang ngực, siêu âm bụng, CT hoặc MRI mỗi 3 tháng trong 2 năm đầu, mỗi 6 tháng trong 2 năm tiếp theo, và mỗi 2 năm sau đó.
Tiên lượng
Chất đánh dấu ung thư, mô học, và giai đoạn là những yếu tố tiên lượng quang trọng trong trượng hợp bướu 1 bên.
Khi áp dụng điều trị đa mô thức thì tiên lượng của bướu Wilm là rất tốt, tỷ lệ sống còn 90%. những trường hợp có anaplasia lan tỏa (diffuse) giai đoạn II hoặc IV có thể có tái phát mặc dù điều trị tối đa có tiên lượng xấu. Tuy nhiên sau khi áp dụng những thuốc mới như cyclophosphamide, ifosfamide, cisplatin, carboplatin, và etoposide, và đặc biệt kết hợp ICE (ifosfamide, carboplatin, etoposide), đã góp phần giảm tái phát đáng kể, tăng tỷ lệ sống còn 50%-60%.[9, 10, 11]
Biến chứng phẫu thuật
- Tắc ruột đại tràng (7%)
- Xuất huyết (6%)
- Nhiễm trùng vết mỗ, thoát vị (4%)
- Biến chứng mạch máu (2%)
- Tổn thương ruột và tạng (1.5%)
Theo Emedicine Medscape Urology
---------------------------------------------------------------------------------------------------
- Ehrlich PF, Ritchey ML, Hamilton TE, Haase GM, Ou S, Breslow N, et al. Quality assessment for Wilms' tumor: a report from the National Wilms' Tumor Study-5. J Pediatr Surg. Jan 2005;40(1):208-12; discussion 212-3.
- Kubiak R, Gundeti M, Duffy PG, Ransley PG, Wilcox DT. Renal function and outcome following salvage surgery for bilateral Wilms' tumor. J Pediatr Surg. Nov 2004;39(11):1667-72.
- Haecker FM, von Schweinitz D, Harms D, Buerger D, Graf N. Partial nephrectomy for unilateral Wilms tumor: results of study SIOP 93-01/GPOH. J Urol. Sep 2003;170(3):939-42; discussion 943-4.
- Metzger ML, Dome JS. Current therapy for Wilms' tumor. Oncologist. Nov-Dec 2005;10(10):815-26.
- Ritchey ML. The role of preoperative chemotherapy for Wilms' tumor: the NWTSG perspective. National Wilms' Tumor Study Group. Semin Urol Oncol. Feb 1999;17(1):21-7.
- Bogaert GA, Heremans B, Renard M, Bruninx L, De Wever L, Van Poppel H. Does preoperative chemotherapy ease the surgical procedure for Wilms tumor?. J Urol. Oct 2009;182(4 Suppl):1869-74.
- Kalapurakal JA, Peterson S, Peabody EM, Thomas PR, Green DM, D'angio GJ, et al. Pregnancy outcomes after abdominal irradiation that included or excluded the pelvis in childhood Wilms tumor survivors: a report from the National Wilms Tumor Study. Int J Radiat Oncol Biol Phys. Apr 1 2004;58(5):1364-8.
- de Kraker J, Graf N, van Tinteren H, Pein F, Sandstedt B, Godzinski J, et al. Reduction of postoperative chemotherapy in children with stage I intermediate-risk and anaplastic Wilms' tumour (SIOP 93-01 trial): a randomised controlled trial. Lancet. Oct 2-8 2004;364(9441):1229-35.
- Dome JS, Green DM, Cotton CA, et al. Treatment of anaplastic Wilms tumor: A report from the National Wilms Tumor Study Group. Am Soc Clin Oncol. 2005;23(16S):802S.
- Fuchs J, Kienecker K, Furtwängler R, Warmann SW, Bürger D, Thürhoff JW, et al. Surgical aspects in the treatment of patients with unilateral wilms tumor: a report from the SIOP 93-01/German Society of Pediatric Oncology and Hematology. Ann Surg. Apr 2009;249(4):666-71.
- Kalapurakal JA, Nan B, Norkool P, Coppes M, Perlman E, Beckwith B, et al. Treatment outcomes in adults with favorable histologic type Wilms tumor-an update from the National Wilms Tumor Study Group. Int J Radiat Oncol Biol Phys. Dec 1 2004;60(5):1379-8
Không có nhận xét nào:
Đăng nhận xét